Der Attersee: Unterschied zwischen den Versionen
Admin (Diskussion | Beiträge) |
Admin (Diskussion | Beiträge) |
||
| Zeile 162: | Zeile 162: | ||
Jakob Heckel (1851) → ''[https://www.zobodat.at/pdf/SBAWW_07_0281-0333.pdf Bericht einer auf Kosten der kais. Akademie der Wissenschaften durch '''''Oberösterreich''''' nach Salzburg ... unternommenen Reise]''. Si.-Ber. AdW math.-naturw. Klasse, 1851, S. 281–333. | Jakob Heckel (1851) → ''[https://www.zobodat.at/pdf/SBAWW_07_0281-0333.pdf Bericht einer auf Kosten der kais. Akademie der Wissenschaften durch '''''Oberösterreich''''' nach Salzburg ... unternommenen Reise]''. Si.-Ber. AdW math.-naturw. Klasse, 1851, S. 281–333. | ||
| − | * Die Fische des Attersees: S. 285-293: Bericht des Fischers Schmoller von Schörfling: Huchen (Salmo Hucho Linn.) – nur in Dürrer Ager bis St. Georgen. 22 Arten im Attersee: Lachsforelle (Fario Marsilii Heck.); † Maiforelle (Salar Schiffermülleri Valenc.); Saiblinge (Salmo Salvelinus Lin.); Bachforelle (Salar Ausonii Valenc.); der Asch (Thymulus vexillifer Agass.) nahe dem Ausfluss; Rheinanken (Coregonus Wartmannii Cuv.); eng verwandt mit den kleineren Kröpflingen (Coregonus Fera Cuv.); Schied (Abramis Vimba Cuv.); Brachsen (Abramis Beama Cuv.); Perlfisch oder Weissfisch (Leuciscus Meidingeri Heck.); Döbel (Squalius Dobula Heck.) in zwei Arten; Bitterling (Rhodeus amarus Agass.); Rotfeder (Scardinius erythrophthalmus Bonap.); Rothäugeln (Leuciscus rutilus Cuv.); Elritze (Phoxinus Marsilii Heck.), auch Pfrillen/ | + | * Die Fische des Attersees: S. 285-293: Bericht des Fischers Schmoller von Schörfling: Huchen (Salmo Hucho Linn.) – nur in Dürrer Ager bis St. Georgen. 22 Arten im Attersee: Lachsforelle (Fario Marsilii Heck.); † Maiforelle (Salar Schiffermülleri Valenc.); Saiblinge (Salmo Salvelinus Lin.); Bachforelle (Salar Ausonii Valenc.); der Asch (Thymulus vexillifer Agass.) nahe dem Ausfluss; Rheinanken (Coregonus Wartmannii Cuv.); eng verwandt mit den kleineren Kröpflingen (Coregonus Fera Cuv.); Schied (Abramis Vimba Cuv.); Brachsen (Abramis Beama Cuv.); Perlfisch oder Weissfisch (Leuciscus Meidingeri Heck.); Döbel (Squalius Dobula Heck.) in zwei Arten; Bitterling (Rhodeus amarus Agass.); Rotfeder (Scardinius erythrophthalmus Bonap.); Rothäugeln (Leuciscus rutilus Cuv.); Elritze (Phoxinus Marsilii Heck.), auch Pfrillen/Frirln genannt; Seelaube (Alburnus Mento Heck.); Barbe (Barbus fluviatilis Cuv.), Schmoller bestätigt den giftigen Rogen; Bartgrundel (Cobitis barbatula Lin.); Quappe (Lota communis Cuv.); Hecht (Esox Lucius), bis 48 Pfund schwer; Koppe (Cottus gobio Lin.); Schratz {Perca fluviatilis Lin.), auch: Flussbarsch (Anm.: wahrscheinlich verbuttet, da als Letzter genannt). |
Jakob Heckel (1852): → ''[https://www.zobodat.at/pdf/SBAWW_08_0347-0391.pdf Fortsetzung des im Julihefte 1851 enthaltenen Berichtes über eine, auf Kosten der kais. Akademie der Wissenschaften unternommene, ichtyologische Reise]''. Si.-Ber. AdW math.-naturw. Klasse, 1852, S. 347–391. | Jakob Heckel (1852): → ''[https://www.zobodat.at/pdf/SBAWW_08_0347-0391.pdf Fortsetzung des im Julihefte 1851 enthaltenen Berichtes über eine, auf Kosten der kais. Akademie der Wissenschaften unternommene, ichtyologische Reise]''. Si.-Ber. AdW math.-naturw. Klasse, 1852, S. 347–391. | ||
Version vom 28. Oktober 2023, 19:12 Uhr
Inhaltsverzeichnis
Die außergewöhnlichen Eigenschaften des Wassers
Das Wasser der Erde
Die Erde besitzt insgesamt 35 Milliarden km³ Wasser und bedeckt damit 70 % der Erdoberfläche – das sind 520 Millionen km².
Davon sind nur 24,3 Millionen km³ (= 0,7 ‰) in Form von Eis (Polareis, Gletscher, Schnee, Permafrost) und 10,5 Millionen km³ als Grundwasser vorhanden. 122.000 km³ sind in Süßwasserseen, Bodenfeuchte, Mooren/Sümpfen und Flüssen enthalten. Die Atmosphäre trägt 12.900 km³ Wasser.
Hieraus lässt sich ermitteln, dass durch das Abschmelzen des Grönlandeises der Weltmeeresspiegel um rd. 6 m ansteigen würde. Unter der Annahme, dass alle Eismassen der Erde abschmelzen würden, stiege der Spiegel des Weltmeers um rd. 47 m an. (Anm.: Da der Meeresspiegel zum Höhepunkt der letzten Eiszeit um 120 m tiefer als heute lag, kann man schließen, dass damals mehr als drei Mal so viel Wasser als Eis vorhanden war.)
Dipol-Eigenschaft von Wassermolekülen
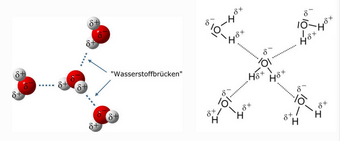
Wassermoleküle bestehen aus zwei Wasserstoffatomen und einem Sauerstoffatom (H2O). Da die Wassersstoffatome bei der Elektronenpaarbindung ihre Elektronen an das Sauerstoffatom abgeben, zeigen sie elektrisch eine positive Ladung und das Sauerstoff eine doppelte negative Ladung.
Da sich die positiv geladenen Wasserstoffatome seitlich in einem Winkel von 104,5° an das negativ geladene Sauerstoffatom anlagern – und nicht entlang einer geraden Linie – wirkt das Wassermolekül elektrisch als ein Dipol.
Wasserstoffbrücken durch Dipol-Dipol-Wechselwirkungen
Die Wassermoleküle richten sich nun so aus, dass die Plus- und die Minus-Teilladungen zueinander zeigen und damit die einzelnen Wassermoleküle durch die elektrischen Anziehungskräfte stark aneinander gebunden werden. Jedes elektropositive Wasserstoffatom eines Wassermoleküls versucht, möglichst in der Nähe eines elektronegativen Sauerstoffatoms eines anderen Moleküls zu sein (das sind die sogenannten "Wasserstoffbrücken"; vgl. die Abbildung).
Diese Wirkung erkennt man auch daran, dass Wasser in Form von Tropfen auftritt und "Wasserläufer" aufgrund dieser Oberflächenspannung über das Wasser laufen können.
Diese Wasserstoffbrückenbildung führt zu Clustern von Wassermolekülen. Je niedriger die Temperatur des Wassers, umso mehr lagern sich die Moleküle aneinander, je höher die Temperatur umso weniger Brücken gibt es.
Ohne diesen Dipolcharakter samt den dadurch hervorgerufenen Wasserstoffbrücken, die die einzelnen Moleküle aneinander binden, wäre Wasser bei normalen Temperaturen keine Flüssigkeit sondern ein Feststoff und hätte seinen Schmelzpunkt bei –100 °C und den Siedepunkt bei –80 °C – und es gäbe kein Leben auf der Erde.
Dichte-Anomalie des flüssigen Wassers
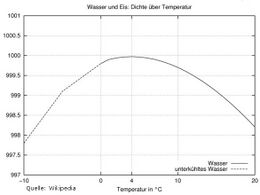
Nur bei Wasser steigt die Dichte beim Erwärmen von 0°C auf 4°C zunächst etwas an und beginnt erst dann zu sinken. Dieser Umstand ist lebensnotwendig für das Leben in Gewässern, denn das 4°C kalte Wasser sinkt nach unten. Die Gewässer können dadurch im Winter nicht vollständig durchfrieren und die Wassertiere können in der Nähe des Gewässerbodens überleben.
Die Dichteänderung von Wasser nimmt mit steigender Temperatur (vgl. die Grafik) rasch zu: Der Unterschied zwischen 24 und 25 °C ist dabei ungefähr 26-mal so groß, wie jener zwischen 4 und 5 °C. Als Faustregel kann gelten, dass Wasser bei 25 °C um rund 0,5 % leichter ist als bei 4 °C. Bei Seen resultiert daraus die große vertikale Schichtungsstabilität im Sommer.
Gleichzeitig bedeutet dies, dass nur im Frühjahr und im Spätherbst – wenn das (sauerstoffreiche) Oberflächenwasser und das Tiefenwasser gleiche Temperatur und damit gleiche Dichte haben – es zu einer Umwälzung des gesamten Seewassers kommt; nur dadurch wird ermöglicht, dass auch in großer Wassertiefe genügend Sauerstoff für Lebewesen vorhanden ist.
Dichte-Anomalie von Eis/Wasser
Im Allgemeinen hat ein Stoff im festen Zustand eine größere Dichte als im geschmolzenen Zustand: Ein Eisenstück sinkt in einer Eisenschmelze genauso auf den Boden wie eine Kerze in flüssigem Wachs. Eis dagegen schwimmt auf flüssigem Wasser, denn die Dichte von Eis ist mit 0,92 g/cm3 geringer als die Dichte von flüssigem Wasser (1 g/cm3). Eis ist daher bei 0 °C um rund 8,4 % leichter als Wasser. Diese Anomalie ist darauf zurückzuführen, dass sich beim Gefrieren eine Gitterstruktur mit Hohlräumen bildet. In Form von Eis sind dadurch die Wasser-Teilchen weniger dicht gepackt als im flüssigen Wasser. Dies bedingt auch, dass Seen von oben her zufrieren.
Spezifische Wärme, Schmelzwärme und Verdunstungswärme
Spezifische Warme ist die Energiemenge, um 1 kg eines Stoffes um 1 °C zu erwärmen. Bei Wasser ist das die Definition einer „Kalorie“ (= 4,1868 kJ) für die Erwärmung von Wasser von 14,5 auf 15, 5 °C. Demgegenüber hat Eis hat eine geringere spezifische Wärme von 2,04 kJ. Die vergleichsweise hohe spezifische Wärme von Wasser bedeutet, dass hohe Wärmemengen gespeichert werden und damit z.B. große Wasserkörper das Klima stark beeinflussen. Zugleich ergibt sich daraus, dass Wasser ein hohes thermisches Puffervermögen gegenüber tages- und/oder jahreszeitlichen Temperaturschwankungen besitzt.
Da beim Verdunsten die Wasserstoffbrücken überwunden werden müssen, lässt sich Wasser nur mit sehr hohem Energieaufwand verdunsten: um 1 Liter Wasser zu verdunsten sind 2.257 kJ Energie erforderlich.
Die türkise Farbe des Attersees
Kalziumkarbonat (mit der chemischen Formel CaCO3) – früher als „kohlensaurer Kalk“ bezeichnet – ist das Calcium-Salz der Kohlensäure (H₂CO₃ aus H2O + CO2) und besteht im festen Zustand aus einem Ionengitter mit Ca2+-Ionen und CO32--Ionen im Verhältnis 1:1.
Das Kalziumkarbonat im Wasser des Attersees stammt vom Kalk des Höllengebirges und löst sich im Wasser in seine beiden Bestandteile auf - wobei die Löslichkeit von den jeweiligen Umgebungszuständen abhängt.
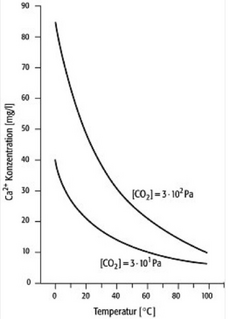
Die Calcit-Löslichkeit in Wasser (vgl. die nebenstehende Abbildung) sinkt mit steigender Temperatur und – vor allem – sinkendem Kohlendioxid-Partialdruck. In der Grafik zeigt die obere Kurve die Ca2+-Konzentration der gesättigten Lösung (in mg/Liter Wasser) im Gleichgewicht mit nicht gelösten Calcitkristallen im Wasser bei einem CO2-Partialdruck von 300 Pa; die untere Kurve das Gleichgewicht bei einem CO2-Partialdruck von 30 Pa.
Der chemische Prozess lautet:
- CaCO3 + H2CO3- → Ca2+ + 2HCO3- (Lösung des Calcits)
- CaCO3 + H2O → Ca2+ + HCO3- + OH- (Hydrolyse von Calcit)
Das Phytoplankton (= Algen) aber auch die Wasserpflanzen brauchen zur Photosynthese neben Lichtenergie vor allem Kohledioxid. Die Pflanzen und das Plankton entziehen dazu dem Wasser gelöstes Kohlendioxid. Damit entziehen sie dem Wasser Kohlensäure, die aus Calciumhydrogencarbonat nachgeliefert wird. Dadurch steigt auch der pH-Wert und das Wasser wird alkalischer. Das Calciumhydrogencarbonat zerfällt in Wasser und wasserunlösliches Calciumcarbonat, also Kalk, der in Form winziger - weißer - Kalkkristalle ausfällt.
Diese Kalkkristalle geben dem Atterseewasser den milchigen Farbton. Das Grün des Chlorophylls des Phytoplanktons ergibt in Verbindung mit dem Blau des Himmels die türkise Grundfarbe.
Bei Wasserpflanzen (siehe z.B. in den Aufhamer Buchten) lagert sich das Calciumcarbonat als weißliche Kruste auf den Blättern und Stängeln ab. Durch die Tätigkeit des Phytoplanktons bilden sich im Wasser schwebende feine Kalkkristalle. Diese Kalkkristalle sinken ab und werden als Seekreide abgelagert.
Die Zunahme der Calcitlöslichkeit im Wasser mit steigendem Druck und sinkender Temperatur bedingt aber, dass unterhalb einer kritischen Wassertiefe die Kalkkristalle aber wieder vollständig aufgelöst werden.
Literatur:
- Findenegg 1959, Ingo: → Das pflanzliche Plankton der Salzkammergutseen. Österreichs Fischerei 1959, S. 32-35
- Moog 1982, Otto: → Jahresgang von Phytoplankton und Chlorophyll a im Attersee 1981 – Arbeiten Labor Weyregg – 6_1982: 134–141 (Abb. S. 140)
- Butz 1996, Ilse, Schmid Anna-Maria: → Aqua-Schnee im Attersee?. Österreichs Fischerei 1996, S. 85–91. (Wasserchemie, Planktonarten, biologische Kalkausfällung)
Datenblatt → Attersee 2007–2009
Limnologische Bibliographie zum Attersee: → 26 Literaturstellen bis 1980; viel von Univ. Göttingen.
Moog , Otto: → Seenreinhaltung - Attersee. (Daten, Limnologie etc.)
Datenblatt → Attersee 2007–2009
WIKIWAND: → https://www.wikiwand.com/de/Region_Attersee
6 Bände: → Arbeiten aus dem Labor Weyregg
Moog 1982, Otto: → Arbeiten aus dem Labor Weyregg 1982.
Schindlbauer, Gottfried: Agrargeographie des Atterseegebiets. Diss. 1981, Univ. Salzburg.
Schindlbauer 1982, Gottfried: → Das hydrographische Einzugsgebiet des Attersees – Geographische Untersuchungen als Grundlage für eine Nährstoffbilanzierung. Arbeiten aus dem Labor Weyregg Bd. 6, 1982. S. 17–56. (einzelne Bäche mit Fläche, Bevölkerung, Landwirtschaft usw.) HQ LITERATUR zu Geologie, Hydrologie, Landwirtschaft usw. [Desciption of surface structure taking in consideration geology and nature of soil.]
Schindlbauer 1986, Gottfried: → Das ländliche Siedlungsbild unter besonderer Berücksichtigung der Gehöftformen, dargestellt am Beispiel des Atterseegebietes. JBOÖMV 1986, S. 89–105.
Moog 1982, Otto: → Jahresgang von Phytoplankton und Chlorophyll a im Attersee 1981 – Arbeiten aus dem Labor Weyregg – 6_1982: 134–141 (Abb. S. 140)
Klima und Wetter: → Das Klima und durchschnittliche Wetter das ganze Jahr über am Attersee
Die jüngere Geschichte des Attersees
Behbehani 1986, Ahmad; Müller, J.; Schmidt, R.; Schneider, J.; Schröder, H.; Strackenbrodk, I.; Sturm, M.: → Sediments and sedimentary history of Lake Attersee (Salzkammergut, Austria). Hydrobiologia 143, December 1986, p. 233–246. (Historia, Grafiken usw.)
S. 235: Grafik Delta: Flysch vs. Moränen !!! UND: 9.1 WIEDERBEWALDUNG
- Hydrobiologia articles are published open access under a CC BY licence (Creative Commons Attribution 4.0 International licence). (https://www.springer.com/journal/10750/how-to-publish-with-us#Fees%20and%20Funding)
Der Attersee ist ein gutes Beispiel für einen See, der im nördlichen Vorland der Nördlichen Kalkalpen liegt und während des Postglazials von verschiedenen sedimentliefernden Prozessen beeinflusst wurde. Die Sedimente des Beckens bestehen aus mehreren Komponenten unterschiedlichen Ursprungs. Aus den Nördlichen Kalkalpen stammen Klastika, die hauptsächlich aus Dolomiten bestehen. Der klastische Eintrag von organischen und anorganischen Partikeln erfolgt durch Flüsse und Erdrutsche. Sie sind für den Haupteintrag von Silikaten wie Quarz, Feldspat und Glimmer verantwortlich. Ein großer Teil des Sediments stammt aus autochthonen biogenen Karbonatausfällungen. In den flachen sublitoralen Bereichen des nördlichen Teils des Sees dominiert die benthische Entkalkung durch verkrustende Makro- und Mikrophyten, während in den südlichen und zentralen Teilen des Sees die epilimnische Entkalkung durch die Blüte des Phytoplanktons im Sommer wichtiger ist. Die gesamte biogene Kalziumkarbonatproduktion erreicht etwa 11000 bis 12000 Tonnen pro Jahr.
Nährstoffe und Rückstände von Cyanophyten (Oscillatoria rubescens) aus dem eutrophen Mondsee wurden von der Mondseeache in den Attersee gespült. Hohe Phosphorgehalte in den Sedimenten des südlichen Beckens weisen auf eine lokale Eutrophierung im Mündungsbereich der Mondseeache hin. Die durchschnittliche Sedimentationsrate im Attersee kann durch verschiedene Datierungsmethoden bestimmt werden. Die Sedimentationsraten stiegen in den letzten 110 Jahren von 1 mm pro Jahr auf 1,8 - 2 mm pro Jahr als Folge menschlicher Aktivitäten. Es lassen sich fünf Hauptphasen in der nacheiszeitlichen Sedimentationsgeschichte erkennen: Würmmoränen und fein gebänderte Varven (vor 13 000 v. Chr.), das frühe Attersee-Stadium (von 13.000 v. Chr. bis 1200 n. Chr.) und das spätere Attersee-Stadium nach der bayerischen Besiedlung (ab 1200 v. Chr.). Mit Hilfe von Schwermetall- und Isotopenanalysen kann die Sedimentationsgeschichte für die letzten 100 Jahre genauer rekonstruiert werden.
Die Fische des Attersees
Die beiden geschützten Fischarten
Schmall 2010, B. & Ratschan, Cl.: → Perlfisch (Rutilus meidingeri). In: Digitaler Fischartenatlas von Deutschland und Österreich. 43 Seiten. (ganz ausgezeichnete Darstellung!)
Mayr 2006, St.; Wanzenböck, J.: → Der Perlfisch (Rutilus meidingeri (Heckel, 1851)), ein Tiefwasserbewohner unserer Seen: Mythos oder Wahrheit? - Seine Habitatnutzung und Nahrungswahl im Mondsee. Österreichs Fischerei, 2006: 262– 272. 12 Seiten.
Hauer 2014, Wolfgang: → Perlfisch, Aitel oder Hasel. Österreichs Fischerei 2014, S. 67–71
Hauer 1997, Wolfgang: → Seelaube, Mairenke, Schiedling (Chalcalburnus chalcoides mento). Österreichs Fischerei 1997, S. 210.
Interessantes
OÖ Landesfischereiverband: → Heimische Fischarten und Krustentiere. (je Fisch: Abbildung; wesentliche Merkmale; Lebensräume; Nahrung; Größe)
Mikschi 2007, Ernst; Wolfram, Georg: Rote Liste der Fische (Pisces) Österreichs. BMLF, Umwelt und Wasserwirtschaft 2007. 138 Seiten. (detaillierte Darstellungen zu: Seesaibling (S. 67); Bachforelle / Seeforelle (S. 68); Attersee-Rainanke / Kröpfling (S. 71–77); sowie Bewertung der Gefährdung aller österr. Fische)
Link zum → Sportanglerbund Vöcklabruck
Haempel 1951, Oskar: → Giftige Fische. Österreichs Fischerei 1951, S. 149–150.(giftiges Aalblut (auf 60 °C erhitzen hebt Wirkung auf); Thunfisch-Blut; Wels-Blut; der rohe Rogen der Barbe)
Aubrecht 1983, Gerhard: → Fische. (14 Seiten Literaturzusammenstellung; 22 x „Attersee“)
Einsele 1956, Wilhelm: → Über das Endalter unserer Süßwasserfische. Österreichs Fischerei 1956, S. 25–31. (Fische werden rund 10 Jahre alt)
Petz-Glechner 2007, Regina, Petz Wolfgang, Achleitner Stefan: → Fischökologische Charakterisierung von Seeausrinnen einiger österreichischer und bayerischer Seen. Österreichs Fischerei 2007, S. 52–62. (Seeache: Wanderungen von Perlfisch und Seelaube, Ager: v.a. 54% Barbe, 11% Aitel, 25% Koppe)
Älteste Erhebungen der Fischarten im Attersee
Jakob Heckel (1790–1857)
Jakob Heckel (1850): → Beiträge zur Kenntnis der fossilen Fische Österreichs - Abhandlung I.. Denkschr. Akad. d. Wiss. Wien 1850, S. 201-242; mit 13 Bild-Tafeln. Abbildungen auf den Seiten 43-59. (97 MB)
Jakob Heckel (1851) → Bericht einer auf Kosten der kais. Akademie der Wissenschaften durch Oberösterreich nach Salzburg ... unternommenen Reise. Si.-Ber. AdW math.-naturw. Klasse, 1851, S. 281–333.
- Die Fische des Attersees: S. 285-293: Bericht des Fischers Schmoller von Schörfling: Huchen (Salmo Hucho Linn.) – nur in Dürrer Ager bis St. Georgen. 22 Arten im Attersee: Lachsforelle (Fario Marsilii Heck.); † Maiforelle (Salar Schiffermülleri Valenc.); Saiblinge (Salmo Salvelinus Lin.); Bachforelle (Salar Ausonii Valenc.); der Asch (Thymulus vexillifer Agass.) nahe dem Ausfluss; Rheinanken (Coregonus Wartmannii Cuv.); eng verwandt mit den kleineren Kröpflingen (Coregonus Fera Cuv.); Schied (Abramis Vimba Cuv.); Brachsen (Abramis Beama Cuv.); Perlfisch oder Weissfisch (Leuciscus Meidingeri Heck.); Döbel (Squalius Dobula Heck.) in zwei Arten; Bitterling (Rhodeus amarus Agass.); Rotfeder (Scardinius erythrophthalmus Bonap.); Rothäugeln (Leuciscus rutilus Cuv.); Elritze (Phoxinus Marsilii Heck.), auch Pfrillen/Frirln genannt; Seelaube (Alburnus Mento Heck.); Barbe (Barbus fluviatilis Cuv.), Schmoller bestätigt den giftigen Rogen; Bartgrundel (Cobitis barbatula Lin.); Quappe (Lota communis Cuv.); Hecht (Esox Lucius), bis 48 Pfund schwer; Koppe (Cottus gobio Lin.); Schratz {Perca fluviatilis Lin.), auch: Flussbarsch (Anm.: wahrscheinlich verbuttet, da als Letzter genannt).
Jakob Heckel (1852): → Fortsetzung des im Julihefte 1851 enthaltenen Berichtes über eine, auf Kosten der kais. Akademie der Wissenschaften unternommene, ichtyologische Reise. Si.-Ber. AdW math.-naturw. Klasse, 1852, S. 347–391.
- S. 376 zu den Coregonen - Rheinanken-Arten in den Salzkammergutseen
Heckel , J. (1851): Über die in den Seen Oberösterreichs vorkommenden Fische. Sitz. Math.-nat. Klasse Kais. Akad. Wiss. Wien 6 (2), 145-149.
Jakob Heckel (1858) & Rudolf Kner: → Die Süßwasserfische der österreichischen Monarchie. Monografien Vertebrata Pisces, 1858; 398 Seiten mit 204 Abbildungen. (31 MB).
- Suchergebnisse: Attersee 14x, Traunsee 5x, Mondsee (Perlfisch) 1x, Traun 20x, Vöckla (S. 246!) 1x, Ager 1x, Donau 96x ((nach Fischer Schmoller; jeweils eine Abbildung; Barbe, Bitterling, Brachsen, (Blau-)Nase („Schied“), Rotauge, Perlfisch, Aitel, Schleie, Kröpfling, Äsche, Hecht, Aalrutte, Barsch, Seelaube, Seeforelle, Elritze, Koppe …)
Fitzinger Leopold (1802-1884)
Fitzinger (1879) Leopold: → Bericht über die im Erlaph- und Lunzer-See vorkommenden Fischarten. Si,-Ber. AdW, math.-naturwiss. Kl., 1879, S. 597.
Aus dem Kammer- oder Atter-See habe ich nur 26 verschiedene Arten aus 6 natürlichen Familien kennen gelernt.
Es sind dies folgende: Flussbarsch (Perca fluviatilis) und Zander (Lucioperca Sundra) aus der Familie der Barsche, — Hecht (Esox Lucius) aus der Familie der Hechte, — Äsche (Thymallus vexillifer), Reinanke (Coregonus Wartmanni), Kröpfling (Coregonus Fera), Seesaibling (Salmo Salvelinus, Var. Marsilii), Seeforelle (Trutta lacustris) nebst Var. Maiforelle (Schiffermülleri) und Seeforelle (Trutta Favio, Var. Lacustris) aus der Familie der Salme, — Barbe (Barbus fluviatilis(, Karpfen (Cyprinus Carpio), Bitterling (Rhodeus amarus), — Brachse (Abramis Brama) — Rußnase (Vimba Zerta) nebst Var. Schiedling (melanops), Laube (Alburnus lucidus), Seelaube (Alburnus Mento), Ukelei (Alburnus bipunctatus), Rotfeder (Scardinius erythrophthalmus), Rotauge (Rutilus rutilus), Döbel (Cephalus Dobula), Perlfisch (Leuciscus Meidingeri) und Elritze (Phoxinus Marsilii) aus der Familie der Karpfen, — Schmerle (Barbatula vulgaris) und ? (Acanthops Taenia) aus der Familie der Schmerlen. — Groppe (Cottus Gobio) aus der Familie der Groppen — und Quappe (Lota vulgaris) aus der Familie der Schellfische.
Oskar Haempel (1882–1953)
Haempel 1912, Oskar: → Leitfaden der Biologie der Fische. Verlag F. Enke, Stuttgart. 188 Seiten. (allgemein zu „Fischen“)
Haempel 1915, Oskar: → Das Tier- und Pflanzenleben unserer Alpenseen. Schriften des Vereins zur Verbreitung naturwissenschaftlicher Kenntnisse. Wien 1915, S. 199-229. (eher Lebewesen, Pflanzen; weniger Fische)
Haempel 1918, Oskar: → Zur Kenntnis einiger Alpenseen, mit besonderer Berücksichtigung ihrer biologischen und Fischerei-Verhältnisse. Internat. Revue Hydrobiologie, Leipzig 1918: Volume 8, Issue 3, p. 225-306. → Literaturverzeichnis
Haempel (1926), Oskar: → Zur Kenntnis einiger Alpenseen. IV. Der Attersee; Internat. Revue Hydrobiologie, Leipzig 1926.
- Volume 15, Issue 5-6, p. 273-322. → Zur Kenntnis einiger Alpenseen. IV. Der Attersee. → Literaturverzeichnis
- Volume 16, Issue 3-4, p. 180-232. → Zur Kenntnis einiger Alpenseen. IV. Der Attersee. Fortsetzung und Schluß.
Haempel 1930, Oskar: → Fischereibiologie der Alpenseen. 1930. 259 Seiten, 28 Abb. 15 Tafeln. (29 €)
Haempel 1951, Oskar: → Giftige Fische. Österreichs Fischerei 1951, S. 149–150.(giftiges Aalblut (auf 60 °C erhitzen hebt Wirkung auf); Thunfisch-Blut; Wels-Blut; der rohe Rogen der Barbe)
Einsele 1959 , W. & Hemsen, J.: → Über die Gewässer des Salzkammergutes, insbesondere über einige Seen. Österr. Fischerei 1959 (5/6), S. 6-31. (Attersee S. 14–16; Fische S. 16 ff. im Attersee zwei unterschiedliche Reinanken-Arten! Saiblinge leben 5 m unter den Renken; S. 25: Bild eines Fischerei-Einbaums am Mondsee 1959)
Ecker, Norbert: → Die fischereiliche Bewirtschaftung des Attersees am Beispiel der Reinanke. Seewalchen, März 2003
Lechner, Barbara: Die Physiogeographie des Attersees. - Diplomarbeit Univ. Innsbruck 1999. 117 Bl. (maschinschr.)
Zach, Otto: → Untersuchungen über das Kleinkrebse- und Rädertierplankton einiger Salzkammergutseen. Jahrbuch des Oberösterreichischen Musealvereines Jg. 125, 1 (1980), 223-238.
Plass, Jürgen (Red.): → ATLAS der Säugetiere Oberösterreichs; Biologiezentrum Linz; 952 S.; 38 MB.
→ Attersee in Wikipedia Bilder etc.
Ge Yu: → Lake Status Records from Europe: Data Base Documentation (C14 usw.)
Stehende Wellen am Attersee und Traunsee
Stehende Wellen: Wie bekannt, werden sie durch Luftdruckschwankungen ausgelöst, die eine Gleichgewichtsstörung der Wassermasse zur Folge haben; letztere ist bestrebt, den Gleichgewichtszustand wieder zu erreichen und pendelt nun um diesen mit einer ganz bestimmten Schwingungsdauer, die von der Form des Seebeckens abhängt, solange, bis wieder Ruhe eintritt, was oft erst nach Tagen der Fall ist. Vollständige Ruhe herrscht eigentlich kaum einmal, doch sind für gewöhnlich die Schwankungen so klein, daß sie nicht beachtet werden. Es werden auch Schwingungsknoten, sowie Längs- und Querschwingungen beobachtet. Die Schreibpegelanlagen des hydrographischen Dienstes haben lange Reihen solcher Schwingungen aufgezeichnet, von denen ein paar besonders schöne Beispiele hier wiedergegeben werden sollen.
Rosenauer 1932, Franz: → Über das Wasser in Oberösterreich. JBOÖMV Abb. 8.
Tauchparadies Attersee (OFFEN E-Mail)
Hois 2014, Harald, Kapfer Gerald: → Unterwasser - ein fotografischer Streifzug durch Seen, Flüsse und Bäche entlang der Ostalpen. Zs. Denisia Bd. 33, S. 9–32. (phänomenale Unterwasser-Bilder)
S. 23–26: Der Attersee gilt als Tauchmekka im Salzkammergut sowie im deutschsprachigen Raum. Der See gilt als das vielfältigste Tauchgewässer Österreichs und zählt zu den besten Süßwasser-Destinationen weltweit. Die Auswahl an Foto-Standorten richtet sich ganz nach den Wünschen der Fotografen: von der Architektur der Unterwasserkuppeln, Anlegestellen (Abb. 26) und Bootshäuser hin bis zu senkrecht abfallenden Steilwänden oder auch zu opulent bewachsenen Abhängen und Uferzonen reicht das Spektrum. Doch damit noch nicht genug:
Schwarmphänomene wie der jährliche Laichzug der bis zu 1m großen Perlfische (Abb. 27) oder die Millionen an Seelauben (Abb. 28) an den Hinkelsteinen sowie an weiteren Bachmündungen machen den Attersee einzigartig.
Die Infrastruktur des Attersees geht soweit, dass neben den vielen Tauchschulen mittlerweile auch Arbeitstauchunternehmen am See Fuß gefasst haben. Die Ausbildung von Arbeitstauchern (Schweißen, Schremmen, Schneiden, Saugen u. v. m.) steht ebenso am Ausbildungsplan, wie der Umgang mit unterschiedlichen Atemgassen für die Offshore-Taucherei (Abb. 29).
E-Mail: harald.hois@aon.at; E-Mail: gerald.kapfer@24speed.at